Judul: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 06, 2009, 07:44:45 PM
Ditulis oleh: sisca, chemistry pada Juli 06, 2009, 07:44:45 PM
1. Pada reaksi pembuatan Amonia, jika diukur pd suhu dan tekanan t'tentu maka 5L gas N2 b'reaksi dgn 9L gas H2 menurut persamaan brkt.
N2 (g) + 3H2 (g) --> 2 NH3 (g)
Volume gas yg t'sisa adlh...
2. Pada suatu suhu t'tentu harga tetapan keseimbangan air (Kw)= 9 × 10-14. Tentukan konsentrasi ion OH – dlm air murni pd suhu tsb!
3. Dgn konsentrasi yg sama, diantara zat-zat brkt,
NaCl
C6H12O6
Na3PO4
CO(NH2)2
Mg SO4
Al2(SO4)3
Ca(CH3COO)2
CH3COOH
C12H22O11
Manakah yg memiliki:
a. Tekanan uap t'rendah
b. Titik didih t'tinggi
c. Titik beku t'tinggi
d. Tekanan osmosis t'besar?
4. Sebyk 160mL larutan senyawa nonelektrolit (Mr=76) dgn kadar 20% massa dan massa jenis 1,25g/ml dicampur dgn 300 mL air. Jika Kf air 1,9, titik beku campuran adlh...
5. P'bandingan p'nurunan titik beku larutan nonelektrolit X dgn larutan elektrolit Y adlh 2:3. Jika Kb air 0,5, titik didih larutan X adlh...
6. Sebyk 100 gr larutan yg mengandung 6gr urea (Mr=60) dan 4gr zat X nonelektrolit mempunyai tekanan uap jenuh sebsr 17,5 mmHg pd 20oC. Jika diketahui tekanan uap jenuh air pd suhu 20oC sebsr 18mmHg, Mr X adlh...
mohon bantuannya....
;)
??? :angel:
N2 (g) + 3H2 (g) --> 2 NH3 (g)
Volume gas yg t'sisa adlh...
2. Pada suatu suhu t'tentu harga tetapan keseimbangan air (Kw)= 9 × 10-14. Tentukan konsentrasi ion OH – dlm air murni pd suhu tsb!
3. Dgn konsentrasi yg sama, diantara zat-zat brkt,
NaCl
C6H12O6
Na3PO4
CO(NH2)2
Mg SO4
Al2(SO4)3
Ca(CH3COO)2
CH3COOH
C12H22O11
Manakah yg memiliki:
a. Tekanan uap t'rendah
b. Titik didih t'tinggi
c. Titik beku t'tinggi
d. Tekanan osmosis t'besar?
4. Sebyk 160mL larutan senyawa nonelektrolit (Mr=76) dgn kadar 20% massa dan massa jenis 1,25g/ml dicampur dgn 300 mL air. Jika Kf air 1,9, titik beku campuran adlh...
5. P'bandingan p'nurunan titik beku larutan nonelektrolit X dgn larutan elektrolit Y adlh 2:3. Jika Kb air 0,5, titik didih larutan X adlh...
6. Sebyk 100 gr larutan yg mengandung 6gr urea (Mr=60) dan 4gr zat X nonelektrolit mempunyai tekanan uap jenuh sebsr 17,5 mmHg pd 20oC. Jika diketahui tekanan uap jenuh air pd suhu 20oC sebsr 18mmHg, Mr X adlh...
mohon bantuannya....
;)
??? :angel:
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 06, 2009, 09:57:00 PM
Ditulis oleh: Idad pada Juli 06, 2009, 09:57:00 PM
Oia.., ni bukan Pr khan.., hehehe/./
klo Pr coba garap sendiri dulu OK..,
Tapi saya anggep ini bener2 nanya kokq.,.,(hehe.., santai aja..) lumayan juga buat ngereview pelajaran yang kemaren2.
1. 2 lIter N2.., Itu pake perbandingan , yang diambil nilai terbesar, Tanya Kenapa? nanti insya Allah sya atambahain di akhir posting. (Ato mungkin udah ada user yang ngejelasin duluan).
2. Telah diketahui sebelumnya bahwa sifat air itu netral. Karena itu, Konsentrasi OH- dan H+ pada Air itu sama. Nah.,. menyelesaikan soal ini pakai penurunan Rumus mencari Kw.
H20 <-> H+ + OH-
K <-> [H+].[OH-] ) / [H20]
K.[H2O] <-> [OH-]^2 --> K.[H2O] inilah yang kita sebut dengan Kw.
Kw <-> [OH-]^2
9x10^-14 <-> [OH-]^2 --> Nah ketemu deh konsentrasi OH- nya.
3. Yang jelas yang Larutan Ion.,. karena untuk rumus sifat Koligatif Larutan, yang Ion pasti dikali I, yaitu jumlah ion pada reaksi. Maka yang paling besar adalah MgSO4
MgSO4 --> Mg 2+ + SO4 2- --> Jumlah ionnya 4
Untuk Kf, Kb dan konsentrasi dianggap sama..,.
4.Itu klo ga salah uda masuk soal campuran.
Triknya --> pahami soal dengan baik. Jawaban saya begini (mudah2an benar)
Delta Tf = Kf . molalitas
tapi di molalitas itu ada pengenceran.., cuma saya lupa cara garapnya.,. mungkin ada yang bisa bantu.
5. Belum mikir lagi..,
6. Buntu..,. uda nulis lumayan cuma q apus lagi.., tpai kayaknya ada hubungannya dengan mol relatif.
Untuk No1 itu, saat kita mencampurkan dua bahan yang salng bereaksi, pasti nanti akan ada perbandingan tertentu dalam reaksi tersebut( hukum Avogadro klo ga salah). Misal, H2O, berarti satu molekul O mengikat dua atom H. Berarti perbandingannya (O:H = 1 : 2)
Untuk soal no 1 daiatas, perbandingannya N2 (g) + 3H2 (g) --> 2 NH3 (g)
1 : 3 : 2
Dan, diketahui ada gasn berjumlah 5L 9L
Agar gas habis bereaksi maka jumlah
idelanya adalah 3L 9L
Kita pakai 1/3 x 9 nutuk menghitung berapa jumlah N2 yang ktia perlukan karena jika kita menggunakan angka 5 sebagai patokan maka reaksi akan kekurangan bahan. Dalam hal ini dapat dikatakan reaksinya tidak mmenuhi perbandingan. Jadi, agar tidka kekurangan bahan, yang jadi acuan ktia adalah bahan terbanyak. Tidak mungkin ktia menempatkan perbandingan
N2 (g) + 3H2 (g) --> 2 NH3 (g)
5L 15L Kalau hal ini terjadi, maka yang terjadi bukannya sisa bahan,
tetapi berapa bahan yang diperlukan (3H2 kurang 6 Liter lagi)
Jaid jawaban yang palnig tepat, itu untuk prbandingan
N2 (g) + 3H2 (g) --> 2 NH3 (g)
5L 9L
3L 9L
Berati tersisa 2L N2
Ok.., (Yah.,. cuma 3 soal bisanya.., oia.,btw itu kan soal sampe kelas 3..., apa sekarang materi kelas 3 ada yang dimajuin ke kelas 2?)
Para Chemistry master mohon penyelesaian dan koremsinya ya..,
klo Pr coba garap sendiri dulu OK..,
Tapi saya anggep ini bener2 nanya kokq.,.,(hehe.., santai aja..) lumayan juga buat ngereview pelajaran yang kemaren2.
1. 2 lIter N2.., Itu pake perbandingan , yang diambil nilai terbesar, Tanya Kenapa? nanti insya Allah sya atambahain di akhir posting. (Ato mungkin udah ada user yang ngejelasin duluan).
2. Telah diketahui sebelumnya bahwa sifat air itu netral. Karena itu, Konsentrasi OH- dan H+ pada Air itu sama. Nah.,. menyelesaikan soal ini pakai penurunan Rumus mencari Kw.
H20 <-> H+ + OH-
K <-> [H+].[OH-] ) / [H20]
K.[H2O] <-> [OH-]^2 --> K.[H2O] inilah yang kita sebut dengan Kw.
Kw <-> [OH-]^2
9x10^-14 <-> [OH-]^2 --> Nah ketemu deh konsentrasi OH- nya.
3. Yang jelas yang Larutan Ion.,. karena untuk rumus sifat Koligatif Larutan, yang Ion pasti dikali I, yaitu jumlah ion pada reaksi. Maka yang paling besar adalah MgSO4
MgSO4 --> Mg 2+ + SO4 2- --> Jumlah ionnya 4
Untuk Kf, Kb dan konsentrasi dianggap sama..,.
4.Itu klo ga salah uda masuk soal campuran.
Triknya --> pahami soal dengan baik. Jawaban saya begini (mudah2an benar)
Delta Tf = Kf . molalitas
tapi di molalitas itu ada pengenceran.., cuma saya lupa cara garapnya.,. mungkin ada yang bisa bantu.
5. Belum mikir lagi..,
6. Buntu..,. uda nulis lumayan cuma q apus lagi.., tpai kayaknya ada hubungannya dengan mol relatif.
Untuk No1 itu, saat kita mencampurkan dua bahan yang salng bereaksi, pasti nanti akan ada perbandingan tertentu dalam reaksi tersebut( hukum Avogadro klo ga salah). Misal, H2O, berarti satu molekul O mengikat dua atom H. Berarti perbandingannya (O:H = 1 : 2)
Untuk soal no 1 daiatas, perbandingannya N2 (g) + 3H2 (g) --> 2 NH3 (g)
1 : 3 : 2
Dan, diketahui ada gasn berjumlah 5L 9L
Agar gas habis bereaksi maka jumlah
idelanya adalah 3L 9L
Kita pakai 1/3 x 9 nutuk menghitung berapa jumlah N2 yang ktia perlukan karena jika kita menggunakan angka 5 sebagai patokan maka reaksi akan kekurangan bahan. Dalam hal ini dapat dikatakan reaksinya tidak mmenuhi perbandingan. Jadi, agar tidka kekurangan bahan, yang jadi acuan ktia adalah bahan terbanyak. Tidak mungkin ktia menempatkan perbandingan
N2 (g) + 3H2 (g) --> 2 NH3 (g)
5L 15L Kalau hal ini terjadi, maka yang terjadi bukannya sisa bahan,
tetapi berapa bahan yang diperlukan (3H2 kurang 6 Liter lagi)
Jaid jawaban yang palnig tepat, itu untuk prbandingan
N2 (g) + 3H2 (g) --> 2 NH3 (g)
5L 9L
3L 9L
Berati tersisa 2L N2
Ok.., (Yah.,. cuma 3 soal bisanya.., oia.,btw itu kan soal sampe kelas 3..., apa sekarang materi kelas 3 ada yang dimajuin ke kelas 2?)
Para Chemistry master mohon penyelesaian dan koremsinya ya..,
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 07, 2009, 09:10:02 PM
Ditulis oleh: sisca, chemistry pada Juli 07, 2009, 09:10:02 PM
siiiip...
nieh bukan PR koq...
makasi buanyak ya...
^^
nieh bukan PR koq...
makasi buanyak ya...
^^
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: nandaz pada Juli 08, 2009, 08:00:16 PM
Ditulis oleh: nandaz pada Juli 08, 2009, 08:00:16 PM
no satu bener dua,,

disini yang habis bereaksi adalah hidrogen(pereaksi pembatas) sebanyak tiga liter untuk satu mol...pers;



___________________

yang tersisa gas nitrogen 2 liter
no dua kelihatannya aku sependapat lagi dengan idad, kalo yang diminta cuman konsentrasi bisa liat lewat persamaan air bukan,
no tiga,
a.
b.dalam hal ini senyawa(dalam koligatif larutan) dengan titik didih paling rendah juga memiliki titik didih paling tinggi jadi jawabannya sama dengan yang dibawah
c.inget rumus dasar dan untuk larutan elektrolit harus dikali vaktor van hoff jadi jawabannya Al2(SO4)3
jadi jawabannya Al2(SO4)3
d.sama jawabannya dengan yang diatas...
takut mati lampu lagi nanti kusambung ya....menjawab versi kedua ;D ;D
disini yang habis bereaksi adalah hidrogen(pereaksi pembatas) sebanyak tiga liter untuk satu mol...pers;
___________________
yang tersisa gas nitrogen 2 liter
no dua kelihatannya aku sependapat lagi dengan idad, kalo yang diminta cuman konsentrasi bisa liat lewat persamaan air bukan,
no tiga,
a.
b.dalam hal ini senyawa(dalam koligatif larutan) dengan titik didih paling rendah juga memiliki titik didih paling tinggi jadi jawabannya sama dengan yang dibawah
c.inget rumus dasar dan untuk larutan elektrolit harus dikali vaktor van hoff
d.sama jawabannya dengan yang diatas...
takut mati lampu lagi nanti kusambung ya....menjawab versi kedua ;D ;D
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 08, 2009, 09:23:19 PM
Ditulis oleh: sisca, chemistry pada Juli 08, 2009, 09:23:19 PM
weuw...
oce dech...
q jg blm priksa... hhe...
lgi ringkas cttan ttg kimia karbon yg laen... byk kali....
ckckckck...
tpi ttep semangat....
bwt nandaz,, semangat juga... hhe...
bwt idad jg,..
bwt xmuanya xmngt dech...
ho5...
tinggl dkit lg nieh...
^^
oce dech...
q jg blm priksa... hhe...
lgi ringkas cttan ttg kimia karbon yg laen... byk kali....
ckckckck...
tpi ttep semangat....
bwt nandaz,, semangat juga... hhe...
bwt idad jg,..
bwt xmuanya xmngt dech...
ho5...
tinggl dkit lg nieh...
^^
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 09, 2009, 05:43:26 AM
Ditulis oleh: Idad pada Juli 09, 2009, 05:43:26 AM
Update No 6.
Kemarin dulu (hari apa gitu lupa).., uda nanya guru kimiaq.., kesimpulannya
Yang no 6 itu:
1. Larutan tak dikenal itu dianggap air, jadi Mr nya bisa dihitung dari , sehingga kemudian bisa dihitung molnya
, sehingga kemudian bisa dihitung molnya
2. Mol terlarut merupakan jumlah mol dua zat yang dilarutkan (atau lebih??, CMIIW)
Jadi
3. Dimasukkan ke Rumus
dengan

Trus dimasukkan deh ke rumus.., insya Allah klo ngitungnya bener jawabnnya ketemu.....
Kemarin dulu (hari apa gitu lupa).., uda nanya guru kimiaq.., kesimpulannya
Yang no 6 itu:
1. Larutan tak dikenal itu dianggap air, jadi Mr nya bisa dihitung dari
2. Mol terlarut merupakan jumlah mol dua zat yang dilarutkan (atau lebih??, CMIIW)
Jadi
3. Dimasukkan ke Rumus
dengan
Trus dimasukkan deh ke rumus.., insya Allah klo ngitungnya bener jawabnnya ketemu.....
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: nandaz pada Juli 09, 2009, 01:14:59 PM
Ditulis oleh: nandaz pada Juli 09, 2009, 01:14:59 PM
Kutip4. Sebyk 160mL larutan senyawa nonelektrolit (Mr=76) dgn kadar 20% massa dan massa jenis 1,25g/ml dicampur dgn 300 mL air. Jika Kf air 1,9, titik beku campuran adlh...yak, no 4. cari gramnya dulu lewat perbandingan dua rumus Molaritas,
nah setelah dapat gram bisa cari molalitas, dan masukkan kepersamaan
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 09, 2009, 08:31:57 PM
Ditulis oleh: sisca, chemistry pada Juli 09, 2009, 08:31:57 PM
siiippp dah...
makasi xmuanya....
makasi bgt....
hhe....
n_________________________n
makasi xmuanya....
makasi bgt....
hhe....
n_________________________n
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 17, 2009, 08:59:56 PM
Ditulis oleh: sisca, chemistry pada Juli 17, 2009, 08:59:56 PM
okay...
hm,,.
yg nmr 5 g'mana????
n nmr 3 aq masi gak ngerti..
mohon bantuannya buat dijelasin lg dunkz...
makasi...
hm,,.
yg nmr 5 g'mana????
n nmr 3 aq masi gak ngerti..
mohon bantuannya buat dijelasin lg dunkz...
makasi...
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 18, 2009, 07:05:37 AM
Ditulis oleh: Idad pada Juli 18, 2009, 07:05:37 AM
@Sisca
Untuk soal no3., mng sya bisa ngasi gambaran sdikit..,
Sifat koligatif larutan itu ada empat macam, yaitu Tekanan Uap, Perubahan Titik Didih, Perubahan Titik Panas, dan Tekanan Osmosis Larutan.
Sifat Koligatif Larutan merupakan perubahan sifat dasar suatu larutan karena masuknya zat baru (yang bisa terlarut) kedalamnya, kita sebut zat ini dengan Terlarut.
Nah, dari sini kita kenal dua istilah, Pelarut dan Terlarut.
Pelarut akan mengalami perubahan sifat koligatif manakala ia di larutkan/direaksikan dengan Terlarut. Secara kasar, ada dua hal penting yang menentukan perubahan sifat itu. Yang pertama adalah banayk/sedikitnya jumlah terlarut yang dimasukkan (hal ini kemudian akan menentukan kadar Molaritas / molalitas terlarut), dan Yang kedua adalah tetapan Koligatif larutan itu sendiri.
Tetapi, selain dua hal diatas, ternyata diketahui perubahan sifat pada Larutan yang dilarutkan dengan Terlarut/Zat Elektrolit (Disebut sebagai Larutan Elektrolit, Larutan Elektrolit adalah Larutan yang komposisi Terlarutnya adalah Zat Ionik) ternyata mempunyai perubahan (delta) sifat koligatif yang jauh lebih besar daripada larutan non-elektrolit.
Misalnya, saat anda melarutkan 10g Gula kedalam air dan 10 gram Garam kedalam air 20g pada wadah berbeda, maka saat anda bekukan, anda akan mendapatkan bahwa Larutan Gula (non-elektrolit) akan membeku lebih cepat daripada larutan Garam (elektrolit) (Bahkan tidka mau membeku pada suhu Freezer normal!!).
Nah, hal ini kelas menunjukkan bahwa ada perbedaan sifat koligatif larutan elektrolit dan larutan non-elektrolit ayng sangat besar. Oleh karena itu, selain dua hal pokok diatas, para kimiawan mengalikan tiap besaran tadi dengan "i"(arti i sendiri saya juga masih belum tahu., mungkin ada yg mw nambah..?)
I sendiri dapat diartikan sebagai derajat keelektrolitan.
i untuk Terlarut Elektrolit Kuat, maka harga i = jumlah ion-ion dari elektrolit tadi
Misal:
Maka HARGA i = 3 .., 1 dari Mg dan 2 Dari
Untuk larutan Elektrolit lemah.., maka Harga i ditentukan oleh rumus
 \quad {\cdot} \quad {\alpha}}) dengan
dengan 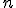 (klo g salah) merupakan jumlah ion pada ion lemahnya.
(klo g salah) merupakan jumlah ion pada ion lemahnya.
Misal,
Maka jumlah n = 2. Dan untuk berarti
berarti
 \quad {\cdot} \quad {\alpha}})
 \quad {\cdot} \quad {20%}} \quad )


Nah.., inin untuk sementara..,
mungkin lanjutannya insya Allah saya tambah nanti..,(ato ada yg mw ngelanjutin u/ penjelasan soal no3..,?)
Untuk soal no3., mng sya bisa ngasi gambaran sdikit..,
Sifat koligatif larutan itu ada empat macam, yaitu Tekanan Uap, Perubahan Titik Didih, Perubahan Titik Panas, dan Tekanan Osmosis Larutan.
Sifat Koligatif Larutan merupakan perubahan sifat dasar suatu larutan karena masuknya zat baru (yang bisa terlarut) kedalamnya, kita sebut zat ini dengan Terlarut.
Nah, dari sini kita kenal dua istilah, Pelarut dan Terlarut.
Pelarut akan mengalami perubahan sifat koligatif manakala ia di larutkan/direaksikan dengan Terlarut. Secara kasar, ada dua hal penting yang menentukan perubahan sifat itu. Yang pertama adalah banayk/sedikitnya jumlah terlarut yang dimasukkan (hal ini kemudian akan menentukan kadar Molaritas / molalitas terlarut), dan Yang kedua adalah tetapan Koligatif larutan itu sendiri.
Tetapi, selain dua hal diatas, ternyata diketahui perubahan sifat pada Larutan yang dilarutkan dengan Terlarut/Zat Elektrolit (Disebut sebagai Larutan Elektrolit, Larutan Elektrolit adalah Larutan yang komposisi Terlarutnya adalah Zat Ionik) ternyata mempunyai perubahan (delta) sifat koligatif yang jauh lebih besar daripada larutan non-elektrolit.
Misalnya, saat anda melarutkan 10g Gula kedalam air dan 10 gram Garam kedalam air 20g pada wadah berbeda, maka saat anda bekukan, anda akan mendapatkan bahwa Larutan Gula (non-elektrolit) akan membeku lebih cepat daripada larutan Garam (elektrolit) (Bahkan tidka mau membeku pada suhu Freezer normal!!).
Nah, hal ini kelas menunjukkan bahwa ada perbedaan sifat koligatif larutan elektrolit dan larutan non-elektrolit ayng sangat besar. Oleh karena itu, selain dua hal pokok diatas, para kimiawan mengalikan tiap besaran tadi dengan "i"(arti i sendiri saya juga masih belum tahu., mungkin ada yg mw nambah..?)
I sendiri dapat diartikan sebagai derajat keelektrolitan.
i untuk Terlarut Elektrolit Kuat, maka harga i = jumlah ion-ion dari elektrolit tadi
Misal:
Maka HARGA i = 3 .., 1 dari Mg dan 2 Dari
Untuk larutan Elektrolit lemah.., maka Harga i ditentukan oleh rumus
Misal,
Maka jumlah n = 2. Dan untuk
Nah.., inin untuk sementara..,
mungkin lanjutannya insya Allah saya tambah nanti..,(ato ada yg mw ngelanjutin u/ penjelasan soal no3..,?)
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: nandaz pada Juli 18, 2009, 09:11:50 PM
Ditulis oleh: nandaz pada Juli 18, 2009, 09:11:50 PM
...n itu jumlah ion, nilai i(faktor van hoff) harus dihitung kecil dari satu, ngga boleh dengan persen...0<i<1, rumus dari idad tadi berguna untuk semua senyawa elektrolit, tidak cuman yang lemah aja...
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 19, 2009, 06:38:58 AM
Ditulis oleh: Idad pada Juli 19, 2009, 06:38:58 AM
Kutip dari: nandaz pada Juli 18, 2009, 09:11:50 PMhm.., bru tau yang "i" itu namanya faktor van hoff..,
...n itu jumlah ion, nilai i(faktor van hoff) harus dihitung kecil dari satu, ngga boleh dengan persen...0<i<1,
oia., btw disoal-soal kok biasanya dissosiasi
Kutipyup.., untuk rumus
rumus dari idad tadi berguna untuk semua senyawa elektrolit, tidak cuman yang lemah aja...
Kutip dari: Idad pada Juli 18, 2009, 07:05:37 AMsebenernya barlaku umum..,
hanya saja.., untuk larutan Elektrolit kuat nilai
jadi pada akhirnya
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 19, 2009, 07:05:35 AM
Ditulis oleh: Idad pada Juli 19, 2009, 07:05:35 AM
oke.., seakarang kita coba bahas sederhana soal no 3
untuk soal seperti ini, yang perama harus kita sadari yaitu di soal tidak diberi keterangan tetang![P^{\circ}[\tex], Kb, Kf, maupun nilai n (mol) pada PV=nRT.<br /><br />Nah.., mengingat demikian, maka Nilia empat konstanta tadi untuk setiap larutan kita anggap sama (misalnya 1)<br /><br />Nah.., enaknya pula.., disoal kita juga dikasi tahu bahwa Konsentrasi tiap larutan adalah sama..,<br />berarti M tiap larutan yagn diatas sama (kita misalkan aja 1.<br />Oh ya.,. sampe lupa.., kan konsentrasi dan molaritas larutan jgua ga diketahui.., ini juga bisa kita anggap 1, karena mereka kita anggap dilarutkan di larutan yang sama..,<br /><br />Dari sini kita simpulkan dulu bahwa..,:<br />1. [tex]P^{\circ}=K_b=K_f=1[\tex],<br />2. [tex]n=1](https://www.forumsains.com/cgi-bin/mimetex.cgi?P^{\circ}[\tex], Kb, Kf, maupun nilai n (mol) pada PV=nRT.<br /><br />Nah.., mengingat demikian, maka Nilia empat konstanta tadi untuk setiap larutan kita anggap sama (misalnya 1)<br /><br />Nah.., enaknya pula.., disoal kita juga dikasi tahu bahwa Konsentrasi tiap larutan adalah sama..,<br />berarti M tiap larutan yagn diatas sama (kita misalkan aja 1.<br />Oh ya.,. sampe lupa.., kan konsentrasi dan molaritas larutan jgua ga diketahui.., ini juga bisa kita anggap 1, karena mereka kita anggap dilarutkan di larutan yang sama..,<br /><br />Dari sini kita simpulkan dulu bahwa..,:<br />1. [tex]P^{\circ}=K_b=K_f=1[\tex],<br />2. [tex]n=1) untuk n apapaun itu.., entah n larutan atau n terlarut..., oke
untuk n apapaun itu.., entah n larutan atau n terlarut..., oke
3. nilai Molaritas dimanapun tetep 1.
Nah.., sekarang ktia amsuk ke rumus.,
1. Rumus Tekanan Uap

jangan lupa nya oke..,
nya oke..,
2. Rumus Titik Beku

3. Rumus Titik Didih

4. Rumus Tekanan Osmosis


 --> M didapat dari n/v
--> M didapat dari n/v
Nah.., sekarang ktia masukkan tiga simpulan tadi ke dalam masign2 rumus.., maka akan didapatkan:
1. Rumus Tekanan Uap

2. Rumus Titik Beku


3. Rumus Titik Didih


4. Rumus Tekanan Osmosis


Nah.., uda sederhana kan.., sekarang untuk mencarai mana yang paling tinggi dan mana yang paling rendah.., sisca tinggal mengionkan masing-masing larutan dan memasukkan nilainya kedalam ,
,
Satu hal lagi yang perlu diinget.., nilai larutan Elektrolit Kuat = 100% dan yang bukan elektrolit kuat nilai
larutan Elektrolit Kuat = 100% dan yang bukan elektrolit kuat nilai 
Oke.., selamat mencoba..,
Kutip
3. Dgn konsentrasi yg sama, diantara zat-zat brkt,
NaCl
C6H12O6
Na3PO4
CO(NH2)2
Mg SO4
Al2(SO4)3
Ca(CH3COO)2
CH3COOH
C12H22O11
Manakah yg memiliki:
a. Tekanan uap t'rendah
b. Titik didih t'tinggi
c. Titik beku t'tinggi
d. Tekanan osmosis t'besar?
untuk soal seperti ini, yang perama harus kita sadari yaitu di soal tidak diberi keterangan tetang
3. nilai Molaritas dimanapun tetep 1.
Nah.., sekarang ktia amsuk ke rumus.,
1. Rumus Tekanan Uap
jangan lupa
2. Rumus Titik Beku
3. Rumus Titik Didih
4. Rumus Tekanan Osmosis
Nah.., sekarang ktia masukkan tiga simpulan tadi ke dalam masign2 rumus.., maka akan didapatkan:
1. Rumus Tekanan Uap
2. Rumus Titik Beku
3. Rumus Titik Didih
4. Rumus Tekanan Osmosis
Nah.., uda sederhana kan.., sekarang untuk mencarai mana yang paling tinggi dan mana yang paling rendah.., sisca tinggal mengionkan masing-masing larutan dan memasukkan nilainya kedalam
Satu hal lagi yang perlu diinget.., nilai
Oke.., selamat mencoba..,
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 19, 2009, 04:24:34 PM
Ditulis oleh: sisca, chemistry pada Juli 19, 2009, 04:24:34 PM
o....
ho5...
okay2..
thx... :D
ho5...
okay2..
thx... :D
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: nandaz pada Juli 19, 2009, 07:39:34 PM
Ditulis oleh: nandaz pada Juli 19, 2009, 07:39:34 PM
Kutip dari: Idad pada Juli 19, 2009, 06:38:58 AMdalam itung
hm.., bru tau yang "i" itu namanya faktor van hoff..,
oia., btw disoal-soal kok biasanya dissosiasikok pake persen ya...?
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: sisca, chemistry pada Juli 20, 2009, 06:48:42 PM
Ditulis oleh: sisca, chemistry pada Juli 20, 2009, 06:48:42 PM
dissosiasi ama ionisasi beda gag..???
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 20, 2009, 08:26:21 PM
Ditulis oleh: Idad pada Juli 20, 2009, 08:26:21 PM
tentu beda..,
karena q kurang ngerti kimia (hehe maklum bukan bidangnya...) ini ada sedikit kopi paste dari wikipedia
1. Dissociation
Dissociation in chemistry and biochemistry is a general process in which ionic compounds (complexes, molecules, or salts) separate or split into smaller molecules, ions, or radicals, usually in a reversible manner. When a Bronsted-Lowry acid is put in water, a covalent bond between an electronegative atom and a hydrogen atom is broken by heterolytic fission, which gives a proton and a negative ion. Dissociation is the opposite of association and recombination. The process is frequently confused with ionization.
2. Ionisasi
Ionization is the physical process of converting an atom or molecule into an ion by adding or removing charged particles such as electrons or other ions. This is often confused with dissociation (chemistry).
N.B.: Ingat lhoh ya.., by adding or removing charged particles, bedakan dengan pengertian Dissosiassi diatas..,
untuk lebih jelasanya mngkin bsa tanya sama nandaz..,
dan boleh juga baca-baac di [pranala luar disembunyikan, sila masuk atau daftar.]
karena q kurang ngerti kimia (hehe maklum bukan bidangnya...) ini ada sedikit kopi paste dari wikipedia
1. Dissociation
Dissociation in chemistry and biochemistry is a general process in which ionic compounds (complexes, molecules, or salts) separate or split into smaller molecules, ions, or radicals, usually in a reversible manner. When a Bronsted-Lowry acid is put in water, a covalent bond between an electronegative atom and a hydrogen atom is broken by heterolytic fission, which gives a proton and a negative ion. Dissociation is the opposite of association and recombination. The process is frequently confused with ionization.
2. Ionisasi
Ionization is the physical process of converting an atom or molecule into an ion by adding or removing charged particles such as electrons or other ions. This is often confused with dissociation (chemistry).
N.B.: Ingat lhoh ya.., by adding or removing charged particles, bedakan dengan pengertian Dissosiassi diatas..,
untuk lebih jelasanya mngkin bsa tanya sama nandaz..,
dan boleh juga baca-baac di [pranala luar disembunyikan, sila masuk atau daftar.]
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: rayfrans pada Juli 22, 2009, 03:59:52 PM
Ditulis oleh: rayfrans pada Juli 22, 2009, 03:59:52 PM
siiip dech idad.
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: nandaz pada Juli 23, 2009, 07:59:05 PM
Ditulis oleh: nandaz pada Juli 23, 2009, 07:59:05 PM
Disosiasi adalah penguraian suatu zat menjadi beberapa zat lain yang lebih sederhana...
derajat disosiasi adalah perbandingan jumlah mol yang terurai darimula2nya...keduanya agak punya pengertian sedikit beda jadi jangan sampai salah paham...
..hmp, ionisasi atau dalam kimia jadi energi ionisasi ::)..jauhan bedanya, energi yang diperlukan untuk melepaskan elektron terluar (paling mudah lepas) dari satu mol atom dalam wujud gas untuk menghasilkan satu mol ion gas dengan muatan 1+. ini bisa dilihat dari [pranala luar disembunyikan, sila masuk atau daftar.]
derajat disosiasi adalah perbandingan jumlah mol yang terurai darimula2nya...keduanya agak punya pengertian sedikit beda jadi jangan sampai salah paham...
..hmp, ionisasi atau dalam kimia jadi energi ionisasi ::)..jauhan bedanya, energi yang diperlukan untuk melepaskan elektron terluar (paling mudah lepas) dari satu mol atom dalam wujud gas untuk menghasilkan satu mol ion gas dengan muatan 1+. ini bisa dilihat dari [pranala luar disembunyikan, sila masuk atau daftar.]
Judul: Re: nieh ada soal kimia dri kls 1 sampe kls 2,, tolong bntu di kerjain y.. makasi...
Ditulis oleh: Idad pada Juli 23, 2009, 08:48:34 PM
Ditulis oleh: Idad pada Juli 23, 2009, 08:48:34 PM
Kutip dari: nandaz pada Juli 23, 2009, 07:59:05 PMhm.., bru ngeh...
Disosiasi adalah penguraian suatu zat menjadi beberapa zat lain yang lebih sederhana...
derajat disosiasi adalah perbandingan jumlah mol yang terurai darimula2nya...keduanya agak punya pengertian sedikit beda jadi jangan sampai salah paham...